为保护人们免受流感病毒感染,并减少与流感有关的死亡人数,生物制品公司每年都需要生产流感疫苗。因此,相关企业能 及时生产和验证各批次流感疫苗是至关重要的。每批疫苗都需根据其中血凝素(HA)含量评估效力。流感病毒可利用血凝素(HA),与宿主细胞膜上的唾液酸受体结合,侵染细胞。[1]
目前评估疫苗批次的金标准方法是单径向免疫扩散(SRID)试验,它让病毒抗原在含有抗原特异性抗体的琼脂糖凝胶中扩散。然后,测量沉淀带的大小,使用一组校准过的参考抗原将沉淀带的大小与样品中抗原的数量相关联[2]。尽管SRID自1978年以来一直在使用,但它有一些缺点。首先,它是一种离线方法,因为样品必须从生产线上取出,通过一个单独的过程进行分析。其次,SRID所需的参比血清和抗原试剂可能需要6个月的准备时间,从而导致疫苗批次上市的延迟[3]。此外,SRID的分析精度和通量也较低[4],执行SRID大约需要22小时[5]。因此,迫切需要开发一种更快速的方法来评估流感和其他疫苗的效力,特别是在流感疫情爆发时期。
虽然有其他基于免疫测定法和色谱法的方法可以确定疫苗制剂中的HA含量,但它们缺乏对生产中病毒颗粒进行过程分析的能力。免疫测定也被认为是费时费力的。而表面等离子体共振(SPR)检测可以在几分钟到几小时内产生实时数据,并且样本无需标记。通过表面化学优化和生物分子选择性捕获,可以实现对目标生物分子的高灵敏度和高重复性的检测。Affinite仪器公司紧凑型的SPR仪器将使基于细胞的病毒颗粒生产的在线实时监测成为现实。
本应用案例将展示利用Affinite的P4SPRTM对流感疫苗生产中HA含量进行监测的潜在用途。
实验过程
系统设置和传感器芯片功能化
本研究使用了配备4个独立微流控通道的P4SPR™(图1)。

图1 4通道分子互作仪P4SPRTM
首先,使用去离子水通过SPR装置运行60s,以确保基线的稳定性。然后,为了减少非特异性结合,使用我们专有的AfficoatTM表面修饰的金膜传感器芯片,并将所有以下蛋白质样品和试剂手动注射到P4SPR中(见图1)。为了激活传感器表面以捕获抗体固定,用EDC/NHS处理;随后用乙酸钠洗涤。将HA捕获抗体(10µg/mL)固定于传感芯片表面,反应20分钟;随后用乙酸钠进行清洗。为了减少非特异性结合,通过注射1 M乙醇胺(pH 8.5)阻断传感器表面的活性位点,反应10分钟。然后用运行缓冲液冲洗传感器表面。图2描述了在金膜传感器芯片上的实验设置。

图2 SPR法检测血凝素的实验示意图
HA标准曲线
利用运行缓冲液制备HA,在A至C通道中从0.5µg/mL滴定至25µg/mL,每次10分钟。图3显示了放置在传感器芯片顶部的微流控通道图案。作为对照,通道D用于注入运行缓冲液。每组HA浓度和运行缓冲液的SPR信号位移保存在P4SPR控制软件中。

图3 四通道分子互作仪P4SPRTM的微流控通道俯视图
结果与讨论
初始的P4SPRTM洗涤、稳定和传感器芯片功能化步骤大约需要38分钟。注入HA样品以创建标准曲线大约需要1小时。因此,生成标准曲线所需的总时间约为1小时40分钟。
依次注射HA浓度时,共振信号成比例增加,证明了HA与固定的抗HA抗体的结合(图4)。在每个HA浓度下,将三个重复的共振信号平均并在Excel中绘制。得到的标准曲线R2为0.98,表明浓度在0.5-25µg/mL之间具有高度的线性关系(图5)。
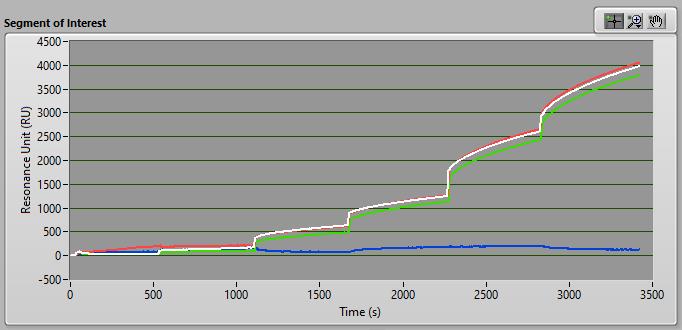
图4 各浓度HA在通道A, B和C(红色、白色、绿色 三次重复)以及参照通道D(蓝色)的传感信号

图5. 血凝素与抗血凝素抗体结合标准曲线
结论
本研究表明,P4SPRTM可以固定抗HA抗体到我们专有的AfficoatTM传感器芯片上,并有潜力通过建立标准曲线来检测样品中的HA浓度。传感器表面准备可在40分钟内完成,每个样品只需要10分钟即可获得数据。通过进一步的实验优化,P4SPR将能够在实际生产和纯化疫苗样品中评估病毒效力。
Affinite仪器优势~
Affinite仪器公司的P4SPRTM四通道设计,无论作多样本筛选,还是重复性检测,都能轻松实现。高效便捷和信号稳定是P4SPR的主要特点;也是百万以内少有的四通道分子互作仪。在疫苗生产过程中,安装在线SPR仪器对疫苗批次进行实时评价是有利的。同时,在生物医药研究的其他领域,P4SPR也能帮助用户揭示生物分子相互作用的奥秘。
参考文献
1. Emi Suenaga, Hiroshi Mizuno & Penmetcha K.R. Kumar. Influenza virus surveillance using surface plasmon resonance. Virulence, 2012, 3, 464-470.
2. M.S. Williams. Single-radial- immunodiffusion as an in vitro potency assay for human inactivated viral vaccines. Vet. Microbiol., 1993, 37, 253-262.
3. Laurent Durous, Thomas Julien, Blandine Padey, Aurélien Traversier, Manuel Rosa- Calatrava, Loïc J. Blum, Christophe A. Marquette, Emma Petiot. SPRi-based hemagglutinin quantitative assay for influenza vaccine production monitoring. Vaccine, 2019, 37, 1614-1621.
4. Carl-Fredrik Mandenius, Ronghui Wang, Anna Alden Gunnar Bergstrom, Sabine Thebault, Charles Lutsch, Sten Ohlson. Monitoring of influenza virus hemagglutinin in process samples using weak affinity ligands and surface plasmon resonance. Anal. Chim. Acta, 2008, 623, 66- 75.
5.C. Estmer Nilsson, S. Abbas, M. Bennemo, A. Larsson, M.D. Hämäläinen, Å. Frostell- Karlsson. A novel assay for influenza virus quantification using surface plasmon resonance. Vaccine, 2010, 28, 759–766.


