Chorus助力绿色多肽合成新方向
直到现在,DMF一直被认为是固相多肽合成(SPPS)的金标准。但是因为其毒性强,危险系数高,被列为CMR剂(致癌、致突变或对生殖有毒的溶剂)。在2021年11月22日,欧盟在其官方公报上发布法规(EU) 2021/2030,增加第76项关于N,N-二甲基甲酰胺(简称DMF或DMFA)的限制条款,正式将DMF纳入REACH法规限制清单。1 规定从2023年12月12日起,该物质本身及含有该物质浓度≥0.3% 的物质或混合物不得投放市场。
正是因为这样,所以亟需找到一种合适的可以替代DMF的方案。世界范围内的多肽相关研究课题组对多种替代性强、更加环保的溶剂或混合物进行了广泛研究,并且对其在SPPS中的潜力进行了评估。2-5
结果发现,有两种替代品具有非常好的应用前景,分别是N-甲基-2-吡咯烷酮(NBP)和二甲基亚砜(DMSO)与乙酸乙酯(EtOAc)的混合物。3-5 下面,就让我们一起来看一下它们在SPPS中的实际应用情况吧。
我们在寻找替代DMF的溶液时,通常溶剂的极性和粘度是需要考虑的关键因素。2
DMSO/EtOAc混合物的危险性比较小,并且可以通过改变各组分的比例来调整溶剂的极性,以获得******的反应条件,例如Fmoc去除和偶联。不过,使用二元混合物也会带来一定的挑战,例如在SPPS过程中,针对不同反应需要使用不同的溶剂比例进行溶剂输送。
另一种替代品NBP,这是一种极性钝化绿色溶剂,在SPPS中具有良好的性能。不过,NBP的粘度较高,难以准确的输送氨基酸和试剂。
利用自带的专利矩阵式液体传输技术(PurePep Pathway)和感应加热功能,PurePep Chorus多肽合成仪可以精确可靠地处理各种溶剂并且自由的调整合适的温度。因此,我们利用它研究了三种不同溶剂系统(DMF、NBP和DMSO/EtOAc)在两种温度下(室温和感应加热到50℃)对三种模型多肽的粗产率和纯度的影响(表1)。
方法
合成
合成三种不同的多肽,分别是Poly-Ala (H-A10K-NH2)、酰基载体蛋白(65-74, ACP, H-VQAAIDYING-OH) 和促性腺激素释放激素(pyroGlu1→Gly, G-LHRH, H-GHWSYGLRPG-NH2)6,7三种肽在常温和高温(50℃)条件下,使用不同的偶联剂二异丙基碳二亚胺/氰基羟基亚胺乙酸乙酯(DIC/Oxyma)和 O-(6-氯苯并三唑-1-基)-N,N,N',N'-四甲基脲六氟磷酸盐/N-甲基吗啉(HCTU/NMM),以 0. 1 毫摩尔合成规模在三种不同溶剂(DMF、NBP 和 DMSO/EtOAc)中进行合成。

以 0.1 mmol 的比例在 Fmoc-Lys(Boc)-Wang树脂 上合成了 PolyAla,在 Fmoc-Gly-Wang 树脂上合成了 ACP,在 Rink Amide MBHA 树脂上合成了 G-LHRH。在 DIC/Oxyma 偶联过程中8使用 0.3 M 氨基酸(6 个当量)、0.4 M Oxyma(8 个当量)和 0.3 M(DIC,6 个当量),持续 2 x 15 分钟。在 HCTU/NMM 反应体系中,使用 0.3 M 氨基酸(6 当量)、0.3 M HCTU(6 当量)和 0.6 M NMM(12 当量)反应 2 x 1 分钟。
Fmoc脱保护使用20% PIP在室温或感应加热到50°C下进行2 x 2分钟。无论使用哪种合成溶剂,用TFA:TIS:水(95:2.5:2.5)在室温下从树脂中切割肽2小时,然后在冷 Et2O 中沉淀,离心并倾倒Et2O。
分析
使用配备 SPD-M20A 检测器的 Shimadzu LCMS-2020 分析粗肽,色谱柱为 ACE Excel 3 C18-PFP,100 x 3.0 mm。流动相为水(A)和含 0.1% 反式脂肪酸的 MeCN(B)混合物。将 ACP 和 G-LHRH 溶于水/乙腈(1:1)中,在 5 分钟内以 5 70% B 的梯度进行分析。PolyAla 肽溶解在纯水中,用 0-60%B 的梯度在 9 分钟内进行分析,流速均为 1 mL/min。
结果和讨论
我们的研究重点是三种肽,它们在合成方面存在独特的挑战。第一种是ACP,一种活性酰基载体蛋白片段,由于在合成过程中容易形成内部二级结构,因此被公认为SPPS的评判标准。6,7 第二种肽是Poly Ala,以其自组装特性而闻名。最后,我们研究了G-LHRH,这是一种因其与促黄体生成激素释放激素(LHRH)的关系而备受关注的多肽。7
这些肽的选择有利于使用不同的合成溶剂对SPPS中的各种肽的合成过程进行全面研究。在改变溶剂系统和温度之后,我们还测试了两种不同的耦合条件:基于碳二亚胺的金标准耦合系统——DIC/Oxyma与安全高效的试剂—— HCTU/NMM。8,9

在DMF中合成
作为参考,使用 DIC/Oxyma 或 HCTU/NMM 偶联试剂在 DMF 中合成 ACP、G-LHRH 和 Poly-Ala,分别在常温和感应加热到50°C。表 2 中显示的结果表明,在50°C下进行DIC/Oxyma偶联比在常温条件下产生的肽纯度更高,这表明温度升高增强了偶联反应并减少了副产物的形成。HCTU/NMM 偶联可实现极快的偶联(2 x 1 分钟)和 Fmoc 去保护(2 x 2 分钟)步骤,从而快速合成所需的多肽。
在NBP中合成
NBP是一种沸点和闪点都很高的双极性非质子溶剂,经常被用作微波辅助多肽合成的溶剂。NBP具有无生产毒性的优点,可获得与DMF相媲美纯度的粗肽。不过,NBP也有缺点,那就是与DMF(25°C 时为 0.8 cP)相比,NBP 的粘度较高(25°C 时为 4.0 cP),这给自动多肽合成仪中试剂的准确传输带来了挑战。
PurePep Chorus多肽合成仪包括一个溶剂校准选项,这对于克服NBP的高粘度带来的输送难题至关重要。通过溶剂校准,用户可以根据需要测量和调整输送到反应容器 (RV) 的液体量。
校准后,如表 1 所示,在NBP中于恒温室进行合成时,所有三种肽都顺利进行,没有出现任何错误。4 然而,由于NBP(高粘度)中的偶联率较低,导致肽的粗纯度略低(27.4% - 52.4%,表2)。
在DMSO/EtOAc中合成
最近的研究表明,DMSO/EtOAc 等非危险性二元溶剂混合物的极性和粘度曲线与DMF相似,可以成为 SPPS 中替代 DMF 的一种可行且危害较小的溶剂。2,3 由于极性对 SPPS 中粗纯度的结果起着至关重要的作用,因此本研究调整了 DMSO/EtOAc 的比例。氨基酸储备溶液(0.3M)以中低极性(DMSO/EtOAc 4:6)配制,DIC溶于EtOAc。
另一方面,FMOC的去保护作用是在极性相对较高的溶剂(DMSO/EtOAc 6:4)中进行的。纯 EtOAc 用作封端溶液,后循环洗涤使用DMSO/EtOAc 2:8,详见表3。
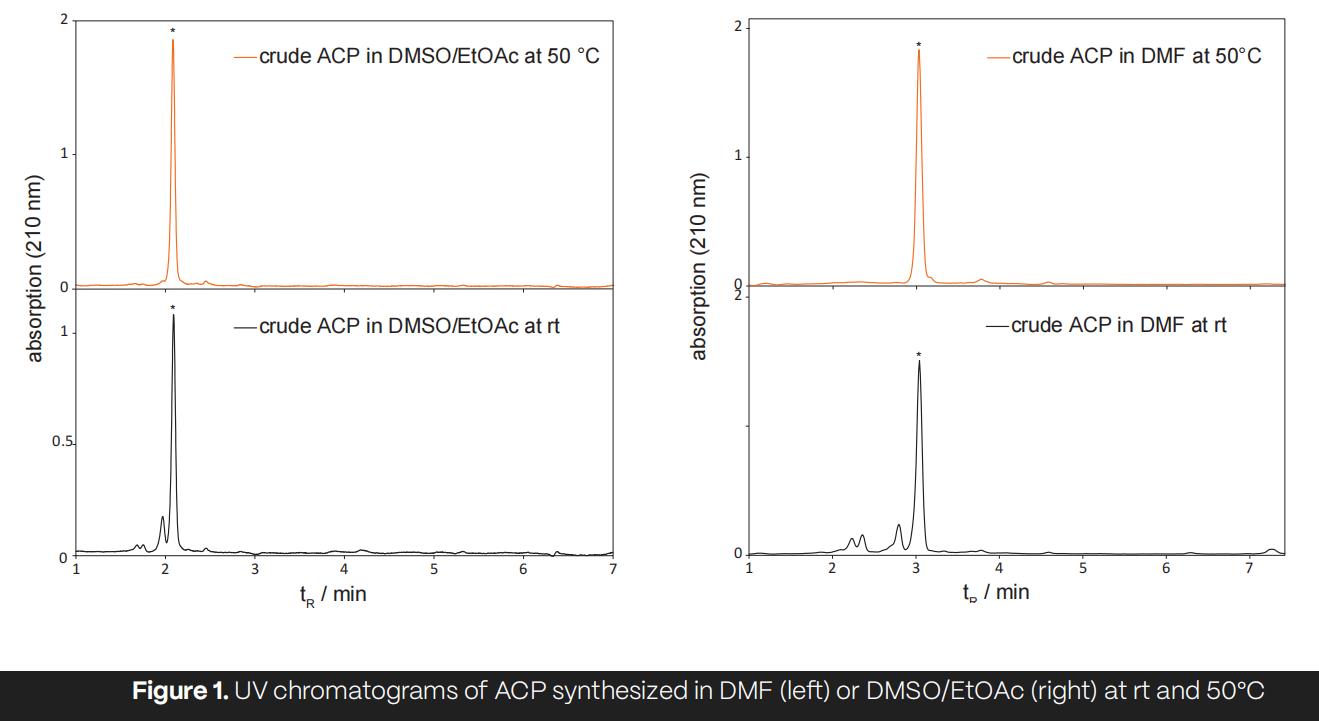
与微波辅助多肽合成不同,Chorus多肽合成仪允许在 SPPS 合成过程中灵活使用各种二元溶剂系统。如表2所示,在DMSO/EtOAc 溶液中,所有三种肽的合成都在恒温条件下顺利进行,得到的粗肽纯度从68.8%到85.4%不等。在 50°C 进行合成时,平均粗纯度从77.9% 提高到82.4%。
图1显示了在 DMF 和 DMSO/EtOAc 中分别获得的粗肽紫外色谱图,证明这两种溶剂系统之间具有良好的转移性。
注:众所周知,二甲基亚砜(DMSO)会在 SPPS 过程中导致蛋氨酸残基氧化。然而,我们在氮气环境下使用 DMSO/EtOAc 混合物成功合成了淀粉样β肽,分析方法证实没有发生任何蛋氨酸氧化(数据未显示)。
PurePep Chorus多肽合成仪的适用性
溶液校准
PurePep Chorus 多肽合成仪(图2)是一种功能强大的固相肽合成(SPPS)设备,可以轻松处理高粘度溶剂和溶剂混合物。该系统的溶剂校准选项可确保精确的溶剂输送,而不论其粘度或成分如何,这对SPPS的成功至关重要。比较所有三种溶剂中的SPPS,DMSO/EtOAc 在恒温条件下的粗纯度优于NBP和DMF。
感应加热
PurePep Chorus 多肽合成仪利用精确的感应加热和振荡功能,在不过热的情况下迅速达到所需的温度。利用这一特点,可以在50℃温度下使用DMSO/EtOAc低沸点二元混合物作为溶剂,进行高效的固相多肽合成 (SPPS)。提高温度可使三种溶剂的平均纯度更高。

结果一览
*在PurePep Chorus多肽合成仪上使用NBP和DMSO/EtOAc代替危险的DMF进行多肽自动合成,可获得高质量的多肽
*在PurePep Chorus多肽合成仪上切换到绿色溶剂的过程可以顺利而快速地完成
*由于可以对二元溶剂混合物进行感应加热,因此可以在高温下使用DMSO/EtOAc
*与DMF和NMP相比,DMSO/EtOAc 在恒温条件下显示出更高的粗纯度,而在50°C条件下显示出与DMF相似的纯度
参考文献
[1] COMMISSION REGULATION (EU) 2021/2030 of 19 November 2021
[2] V. Martin et al., Green Chem 2021, 23, p. 3295
[3] S. Jadhav et al., Green Chem 2021, 23, p. 3312
[4] J. Lopez et al., Org Process Res. Dev. 2018, 22, p. 494
[5] A. Kumar et al., ChemSusChem 2020, 13, p. 5288
[6] D.M. M. Jaradat et.al., Green Chem 2022, 24, p. 6360
[7] V. Martin et.al., RSC Adv. 2020, 10, p. 42457
[8] R. Subirós-Funosas et.al., Eur J Org Chem 2009, 21, p. 9394
[9] C. Hood et.al., Am Biotechnol Lab 2008, 26, p. 22


