化学引诱受体及其同源配体是破坏肿瘤进展级联反应的有前途的药物靶点。大多数化学引诱受体是传统的七次跨膜(7TM)G偶联蛋白受体(GPCRs)1,2。ACKRs(非典型趋化因子受体)与传统的GPCR不同,它不激活引导细胞迁移所需的依赖于 G 蛋白的信号传导3,4。相反,它们通过充当清道夫受体、促进趋化因子内吞作用或产生趋化因子梯度来调节趋化因子的可用性。
C-C基序趋化因子受体样2(CCRL2)是一种与 ACKR 家族相关的非信号转导7TM 受体5。然而,CCRL2与ACKRs不同,因为它缺乏配体清除功能,也缺乏与经典趋化因子结合确认的能力。CCRL2 是一种非信号转导受体,它能与趋化配体结合,使白细胞被招募到炎症部位。然而,人们对直接与 CCRL2 结合的配体类型和功能影响还缺乏了解。
最近在表面等离子体共振领域技术的进步促进了在自然表达条件下配体-受体相互作用的表征。表面等离子体共振(SPR)显微镜结合了SPR和明场显微镜(图1A)来检测未标记分子与细胞表面目标的结合。6-8
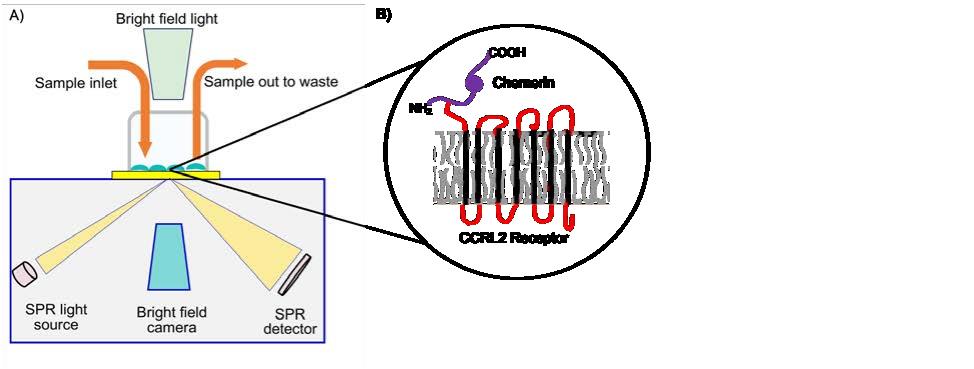
图 1 (A)SPRM 仪器的示意图,描绘了 SPR 和明场输入、细胞室和样品流。9(B) Chemerin 与跨膜 CCRL2 受体结合。
SPRM 测量整个细胞表面分子相互作用的动力学,对于确定配体与细胞表面表达受体的结合速率(ka)、解离速率(kd)和结合亲和力(KD)至关重要。利用BI的ImageSPR™ 分析软件,SPRM 传感器表面被均匀地划分为数百个兴趣区域(ROI)。
在本研究中,使用BI SPRm200仪器证实,在亲代 HEK 293T 细胞和变异型 HEK-huCCRL2 细胞上9,一种非趋化因子趋化蛋白--Chemerin与CCRL2 结合(图 1B)。当Chemerin暴露于HEK-huCCRL2 细胞时,在细胞上观察到大量的ROI(图 2A),但当Chemerin暴露于亲代HEK细胞时,只有少量的ROI出现(图 2B),这表明Chemerin能特异性地结合表达CCRL2 的细胞。采用 1:1 结合模型评估Chemerin与表达 HEK-huCCRL2 细胞结合的动力学数据,显示计算的结合速率、解离速率和结合亲和力(图 2C、D 和 E)直方图趋于稳健高斯分布,其中检测到Chemerin在亲代HEK细胞中的结合率极低,KD 值无法计算。本研究报告了实验中Chemerin与HEK-huCCRL2细胞结合的平均值,包括结合速率(ka = 3.11E+05 M-1 s -1 )、解离速率(kd = 1.16E-03 s -1 )和结合亲和力(KD = 5.49 nM)。重要的是,通过 SPRM 测定的Chemerin与 huCCRL2 结合的平均 KD 与之前报道的通过放射性标记的Chemerin与过表达 huCCRL210 的细胞结合而测定的结合亲和力(2.35 nM)相当10。
 图 2 (A)Chemerin与HEK-huCCRL2细胞结合或(B)Chemerin与HEK细胞结合的SPRM200明场图像;方格表示检测到结合事件的ROI,N=3。根据Chemerin与HEK-huCCRL2细胞结合的ROI传感器图的动力学和数据,产生(C)结合率(ka)、(D)解离率(kd)和(E)结合亲和力(kd)的代表性直方图分布曲线。
图 2 (A)Chemerin与HEK-huCCRL2细胞结合或(B)Chemerin与HEK细胞结合的SPRM200明场图像;方格表示检测到结合事件的ROI,N=3。根据Chemerin与HEK-huCCRL2细胞结合的ROI传感器图的动力学和数据,产生(C)结合率(ka)、(D)解离率(kd)和(E)结合亲和力(kd)的代表性直方图分布曲线。
为了研究生物素标记是否会干扰配体与 HEK-huCCLR2 细胞的结合,使用 SPRm200 仪器评估了一部分无标记的 C-C 趋化因子。当 CCL2 和 CCL5 等无标记趋化因子与 HEK-huCCRL2 细胞孵育时,几乎没有出现 ROI,因此无法计算 KD 值。然而,Biotin-Chemerin与 HEK-huCCRL2 细胞结合的动力学与无标记的Chemerin一致,如表 1 所示。生物素化可以发生在任何活性伯胺上,SPRM 评估Chemerin与 HEKhuCCRL2 细胞结合的结果显示,生物素化对结合的影响可以忽略不计。

表 1 Chemerin与 HEK-huCCRL2 的结合概况
通过 SPRM,可以对一种以前未报道过的 C-C 趋化因子进行直接结合和动力学分析。研究人员测定了 Chemerin 与 HEK 293T 亲本细胞以及 HEKhuCCRL2 变体细胞上的 CCRL2 的结合动力学。
CCRL2 不激活细胞内的 G 蛋白,而是将配体集中在质膜上11 。该受体的下游信号传导机制尚不清楚,因此鉴定能中和 CCRL2 与配体结合的工具是研究其功能的主要途径。为此,我们使用 SPRM 作为一种确证抗体结合的方法,研究两种抗 huCCRL2 单克隆抗体(K097F7 和 152254)与 HEK-huCCRL2 细胞和亲代 HEK 293T 细胞的结合动力学。在 HEK-huCCRL2 细胞上检测到了大量的 ROI(图 3A 和 3B),但在亲代 HEK 细胞上没有检测到。

图 3 (A)K097F7与HEK-huCCRL2细胞结合,(B)152254与HEK-huccRL2细胞结合和(C)同型对照抗体与HEK-huCCRL1细胞结合的SPRM200明场图像;方格表示检测到抗体结合事件的ROI。

表 2 与 HEK-huCCRL2 结合的中和抗体概况
K097F7 和 152254 与 HEK-huCCRL2 细胞的结合亲和力(KD)分别为 2.48 nM 和 4.75 nM(表 2),重要的是,K097F7 和 152254 与亲代 HEK 细胞的最小结合导致 KD 值无法计算。此外,观察到同型对照抗体与 HEK-huCCRL2 细胞的结合极少(图 3C),这表明 K097F7 和 152254 与 CCRL2 是特异性结合。
SPRm200系统将光学显微镜与分子互作技术相结合,专为观察和测量细胞膜表面蛋白和其他目标分子结合亲和力及动力学常数设计,为分子相互作用的研究开辟了新的方法。
(1)SPRm200系统无需对观察目标进行标记,可以实时定量的进行检测;
(2)可同时可视化观察细胞结构和局部结合活性;
(3)无需提取细胞膜蛋白,即可在正常活细胞状态下观察和测量药物和膜蛋白的实时相互作用;
(4)探测器测量每个像素点的SPR响应,并将其映射到SPR图像中,在每个像素处,记录一个传感图,从而提供更多的局部信息。
SPRM技术使在自然条件下研究细胞表面膜蛋白与其他目标分子结合和相互作用成为可能。SPRm200细胞原位分子互作动态分析系统凭借其卓越的灵敏度和稳定性,助力科学研究新发现,推动药物开发新高度。
参考文献
1) Zlotnik A, Yoshie O. Chemokines: a new classification system and their role in immunity. Immunity.2000;12(2):121–7. Pmid:10714678
2) Zlotnik A, Yoshie O. The chemokine superfamily revisited. Immunity. 2012;36(5):705–16. Pmid:22633458
3) Nibbs RJB, Graham GJ. Immune regulation by atypical chemokine receptors. Nat Rev Immunol.2013;13(11):815–29. Pmid:24319779
4) Bonecchi R, Graham GJ. Atypical chemokine receptors and their roles in the resolution of the inflammatory response. Front Immunol. 2016;7:224. Pmid:27375622
5) Schioppa T, Sozio F, Barbazza I, Scutera S, Bosisio D, Sozzani S, et al. Molecular basis for CCRL2 regulation of leukocyte migration. Front Cell Dev Biol. 2020;8:615031. Pmid:33363177
6) Wang W, Yang Y, Wang S, Nagaraj VJ, Liu Q, Wu J, et al. Label-free measuring and mapping of binding kinetics of membrane proteins in single living cells. Nat Chem. 2012;4(10):846–53. Pmid:23000999
7) Wang W, Yin L, Gonzalez-Malerva L, Wang S, Yu X, Eaton S, et al. In situ drug-receptor binding kinetics in single cells: a quantitative label-free study of anti-tumor drug resistance. Sci Rep. 2014;4:6609. Pmid:25312029
8) Zhang F, Wang S, Yin L, Yang Y, Guan Y, Wang W, et al. Quantification of epidermal growth factor receptor expression level and binding kinetics on cell surfaces by surface plasmon resonance imaging. Anal Chem. 2015;87(19):9960–5. Pmid:2636833
9) Su, Z., Brooks, J., Pelker, J., Andreyeva, T., Sobon, H., Gifford, R., Powers, M., Wang, J., Dower, C., Hegen, M. and Messing, D., 2023. Studies with neutralizing antibodies suggest CXCL8-mediated neutrophil activation is independent of CC motif chemokine receptor-like 2 (CCRL2) ligand binding function. PloS one, 18(1), p.e0280590.
10) De Henau O, Degroot GN, Imbault V, Robert V, De Poorter C, McHeik S, et al. Signaling properties of chemerin receptors CMKLR1, GPR1 and CCRL2. PLOS One. 2016;11(10):e0164179. pmid:27716822.
11) Del Prete A, Bonecchi R, Vecchi A, Mantovani A, Sozzani S. CCRL2, a fringe member of the atypical chemoattractant receptor family. Eur J Immunol. 2013;43(6):1418–22. pmid:23580473


