在医学领域,技术的进步常常意味着更快、更准确的诊断和治疗方法。而今,我们引领医学进步的道路,带来了一项革命性的技术——TIGR组织研磨分离仪,以下简称TG。这项技术将彻底改变我们对于细胞诊断的认识,让医学界迈入了一个全新的时代。
TG,是一种基于反向旋转的机械解离装置。通过预先编程的交替切割和研磨步骤,它能够快速、高效地从固体组织中分离出单个活性细胞,无需使用酶类试剂。这项技术的优势不仅在于快速,更在于保留了细胞的生物活性和形态完整性,为后续的诊断和治疗提供了可靠的基础。
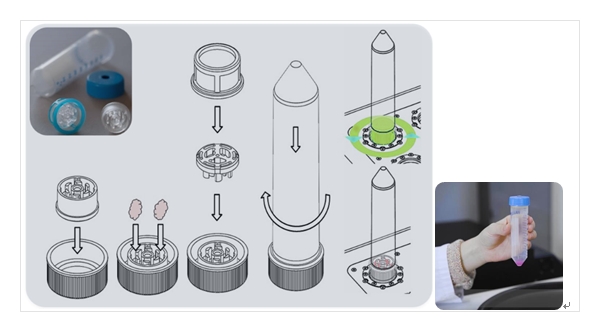
手术期间快速准确的组织病理诊断对临床决策至关重要。目前常用的术中咨询病理学方法耗时、劳动力成本高,并需要受过训练的病理学家的专业知识。
在这里,研究团队引入了一种替代技术(快速、无标记的固体组织活检诊断方法),通过依次评估悬浮的单个细胞的物理表型,实现了对活检样本进行快速、无标记的分析。该方法结合了使用TIGR组织研磨分离仪进行无酶机械解离组织,快速简便地分离出活性单个细胞,以及使用RT–FDC对成千上万个单个细胞的细胞物理表型进行顺序评估。
这种新的诊断流程将组织的无酶机械解离与测量速率为100-1,000个细胞/秒的实时可变形细胞计数仪和基于机器学习的分析相结合。从单个细胞的明场图像中提取的物理表型参数可以用于区分各种组织中的细胞亚群,而无需先验知识或分子标记。此外,我们展示了我们的方法在炎症性肠病诊断中的潜力。通过无监督的维度降低和逻辑回归,我们准确区分了小鼠和人类活检样本中的健康和肿瘤组织。该方法在30 min内提供结果,为快速、无标记的诊断流程奠定了基础,以检测固体活检中的病理变化,适用于术中诊断和病理变化。
这项技术的应用范围广泛,不仅可以用于研究领域的细胞分析,也可以在临床诊断中大显身手。
优势1
TG配合RT-FDC技术先进的微流控芯片,有高速相机和智能数据处理软件,实现实时形态学、机械和荧光参数的获取和分析。RT-FDC技术通过实时监测细胞形态和变形,还可以通过分析细胞的变形、大小等参数,为科研人员提供了更加丰富的数据维度, 进行更加精准的诊断,甚至可以用于癌症的早期检测和疾病的预后评估。
优势2
除此之外,TG还具有无酶、高通量的特点,使其在临床应用中具备了巨大的优势。它不仅可以用于术中诊断,还可以用于实时监测疾病的进展和治疗效果,为临床医生提供了更加及时、精准的诊断和治疗方案。
首先,我们筛选了不同的小鼠组织,并评估了机械解离组织后的细胞产量、存活率以及RT–FDC测量的可行性。我们展示了仅基于图像提取的物理参数就可以区分组织细胞的亚群,而无需先验知识或额外的分子标记,这可以增强传统的流式细胞术。我们还展示了我们的方法可以通过在微流控系统中测量细胞变形来确定结肠组织中的炎症变化。此外,我们还检查了来自小鼠和人类结肠的冷冻和新鲜活检样本,并通过主成分分析(PCA)和机器学习对多维数据进行分析,展示了RT–FDC可以区分健康和癌变组织。这些发现表明,使用RT–FDC评估组织来源的单个细胞的物理表型是一种检测炎症或恶性状态的替代策略。我们的流程可以在30 min内提供结果,并可以在不偏见和无标记的情况下识别和表征组织中的细胞群体的潜力。
结果
机械解离组织的物理表型
在评估细胞的物理表型之前,面临的第一个挑战是在几分钟的时间内快速从固体组织中提取单个细胞,同时旨在******程度准确地代表细胞亚群的异质性。为此,我们使用了TG,这是一种基于反向旋转的研磨齿的机械解离装置(图1),装在锥形底离心管中。该装置自动执行预定义的交替切割和研磨步骤,以从固体组织中分离出单个细胞。使用TG或常规酶解方案处理了十种不同的小鼠组织进行比较。大多数组织的存活率为70–90%;细胞产量与酶解离相似且取决于组织种类。机械解离的关键优势在于处理时间不到5 min/样本,而不是酶解方法的数十分钟甚至几个小时。处理速度可能有助于接近原位条件以此来保留生化和生物物理表型。
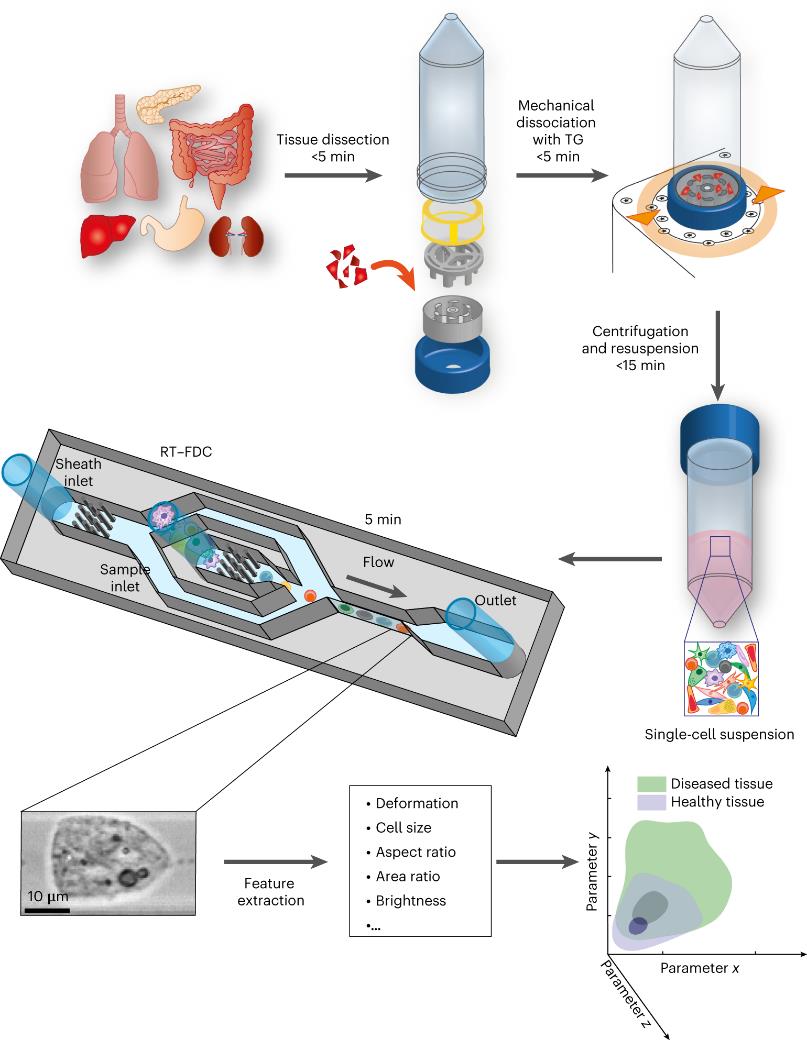
图1| 物理表型分析过程示意图
组织样品被切割成小块并放入含有培养基的组织研磨器内转子中。通过预先编程的自动执行的顺时针和逆时针旋转序列进行机械解离。解离的细胞被离心并悬浮在测量缓冲液中。样品被加载到微流控芯片上,并使用RT-FDC进行分析。对典型的大约10,000个细胞的每个单个的亮场图像进行捕获。从图像中提取各种特征,用于多维分析。总的来说,从组织到结果的整个过程不到30 min。
使用组织的机械解离和基于物理表型的无标记分析时,对于肝脏这样的特定组织,这种方法是否能够真实地代表组织中存在的细胞类型的分布进行了仔细研究。在小鼠肝组织解离后,通过细胞形态和大小测量,确定横截面细胞面积大于150平方微米的细胞为肝细胞。肝细胞是肝脏的主要实质细胞,占肝细胞总数的70%,近80%的肝脏体积。使用TG获得的细胞悬液中,肝细胞占总细胞的平均比例为52.5%,通过机械解离获得的细胞悬液中与酶解消化相比更接近组织中的真实比例。利用细胞大小识别不同的肝细胞亚群,这些亚群与不同倍性的肝细胞相关联。
在RT-FDC测量中,数百个单个细胞悬浮在高粘度的甲基纤维素缓冲液中,经过微流控通道狭缩。在这个过程中,细胞受到剪切应力和压力梯度的影响,导致其变形,并且每个细胞的图像被获取。通过实时计算图像中的几个物理参数,包括细胞的变形、大小、亮度、亮度标准差、长宽比和面积比。此外,通过荧光模块检测细胞表面标记的表达情况。
图2展示了从肝脏、结肠和肾脏中提取的细胞的物理参数分布示例。每个聚类代表具有相似物理表型和表面标记表达的细胞组成的群体。通过图像派生的物理参数,例如细胞大小和平均亮度,可以纯粹地区分出上皮细胞群体,而无需使用额外的荧光抗体面板。在结肠上皮细胞中,可以根据亮度和大小确定多个细胞聚类。在肾脏的白细胞群体中,也可以基于细胞大小和变形参数找到不同的聚类。
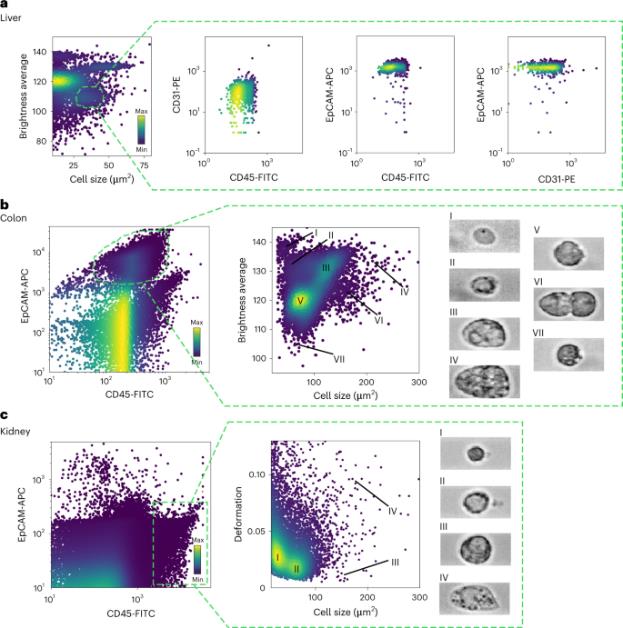
图2| 小鼠肝脏、结肠和肾脏样本细胞物理参数的说明性散点图
a,从肝脏分离的细胞的平均亮度与细胞大小的代表性散点图,显示大量细胞簇。标记的细胞群(形成细胞大小为 25-50 μm2 且亮度平均值在 100-115形成了一个明显的簇)富含 EpCAM 阳性(上皮)细胞,但不含 CD31 阳性(内皮)细胞或 CD45 阳性细胞(白细胞))。FITC,异硫氰酸荧光素;PE、藻红蛋白;APC,别藻蓝蛋白。b,EpCAM 和 CD45 细胞表面标记染色的结肠细胞的说明性散点图。在 EpCAM 阳性群体中,可以根据物理参数(例如亮度和细胞大小)的密度图可以区分7个细胞亚群。c,EpCAM 和 CD45 染色的肾细胞的说明性散点图。在 CD45 群体中,根据细胞大小和变形的相似性确定了4个亚群。散点图中的颜色图表示事件密度。
RT–FDC还可用于捕获细胞相互作用。使用长宽比和细胞大小参数,我们在胸腺、脾脏和肾脏样本中确定了细胞双体。许多双体由两种不同的细胞类型组成,根据细胞表面标记来判断(图3)。通道内的细胞位置与荧光峰的位置相结合,使我们能够确定,例如,双体由白细胞(CD45+)和内皮细胞(CD31+)组成。使用RT–FDC排序模块,可以无标记地分离细胞双体进行进一步的分子分析和下游应用,包括对组织中相互作用的免疫细胞进行研究。
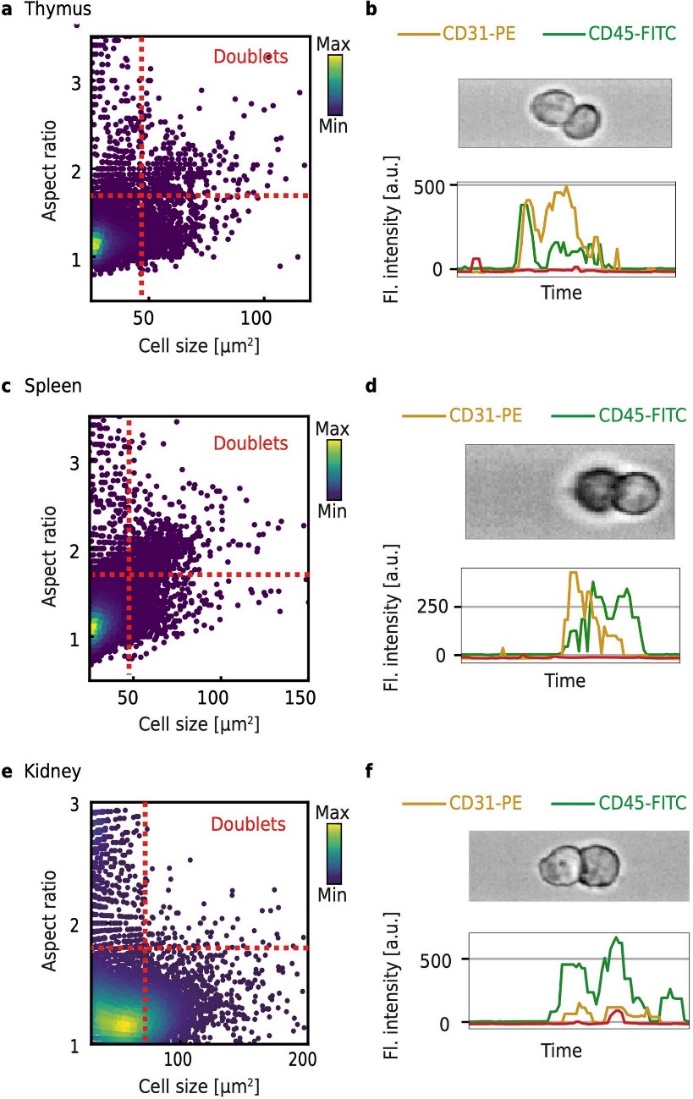
图3| 使用RT-FDC检测细胞二聚体
代表性的细胞从小鼠a胸腺,c脾脏和e肾脏 分离的细胞大小与纵横比的散点图,显示了识别细胞二聚体的门控策略。在b胸腺和d脾脏中鉴定的细胞二聚体及f肾脏中的对应荧光迹线(b、d),显示了白细胞(CD45)与内皮细胞(CD31)相连接,或(f)两个白细胞的相互作用。
人组织制备
从埃尔兰根病理学研究所获得的肿瘤或健康组织手术切除的人类活检样本,立即置于含有10% 胎牛血清(FBS)、1% GlutMAXTM、1% HEPES和1% 青霉素/链霉素的DMEM Advanced培养基中,并存放在4 °C下,立即处理或在液氮中冷冻以备后用。
组织解离和单细胞制备
使用TissueGrinder(TG)进行组织解离。简单地说,将组织样本切成约1-2 mm大小的小块,并放入800μL含有2% FBS的DMEM于TG的转子中。将转子单元放置在一个50 ml离心管的盖子中,带有100 μm细胞筛的定子插入到转子的顶部。将50 ml离心管放置在盖子上,旋紧并放置在TissueGrinder设备上(见图1)。每种组织类型的研磨过程参数总结在表1中。在研磨过程之后,将离心管倒置到架子上,打开,并用5 ml DMEM,2% FBS冲洗细胞过滤器。流过物被转移到15 ml离心管中,并在300 g离心8 min。然后抽取上清液,将细胞沉淀用2 ml PBS(含2% FBS)洗涤,通过带有细胞过滤器盖的FACS管,并在300 g离心5 min。将细胞沉淀悬浮在高粘度测量缓冲液中,该缓冲液由稀释在无钙镁磷酸盐缓冲液(PBS)中的0.6%(w/w)甲基纤维素(4,000 cPs; Alfa Aesar)制备而成。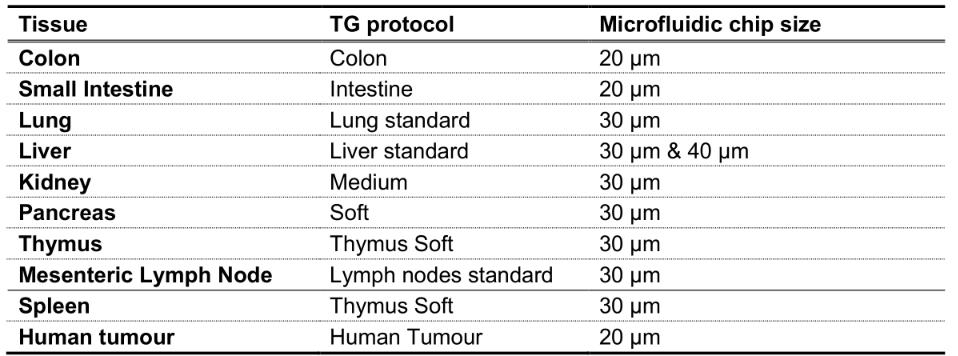
表1:用于机械解离的小鼠器官和相应的TG方案流程,以及用于RT-FDC测量的微流控芯片大小
通过细胞的物理表型来鉴定组织炎症
炎症性肠病(IBD),如克罗恩病和溃疡性结肠炎,是与受损的上皮/黏膜屏障以及免疫细胞的激活/招募相关的肠道慢性炎症性疾病。尽管IBD的病因尚未完全理解,但我们对IBD的理解很大程度上来自实验动物模型的研究。其中一种模型是将原始T细胞转移入Rag1缺陷小鼠中诱导实验性结肠炎(慢性结肠炎的T细胞转移模型,以下简称转移性结肠炎)。然后通常通过来自结肠组织的用伊红染和伊妥珠染的切片生成的组织病理学评分来量化其严重程度。
在转移性结肠炎动物模型中对结肠细胞的物理表型变化进行的调查。通过细胞的变形与大小的散点图(见图4),发现疾病组织中的细胞似乎比健康组织中的细胞变形较小。在检查CD45+细胞后,发现转移性结肠炎样本中存在大量变形较小的白细胞,可能是淋巴细胞。总体上,转移性结肠炎样本的中位数变形显著减少,并且伴随着白细胞百分比的显著增加,符合淋巴细胞的浸润。细胞的中位数变形与白细胞百分比呈强烈的负相关。此外,细胞大小和变形的中位数值与专家的组织病理学评分相关。值得注意的是,健康组织比患病组织更难机械分离成单个细胞,患病组织产生了更多的分析事件。
我们观察到,在炎症期间细胞的物理表型发生变化,加上越来越多的证据表明慢性炎症与恶性肿瘤相关,这导致我们推测我们的方法可能会检测到肿瘤活检样本的变化。我们证实了这种可能性,对于小鼠和人类样本都是如此。
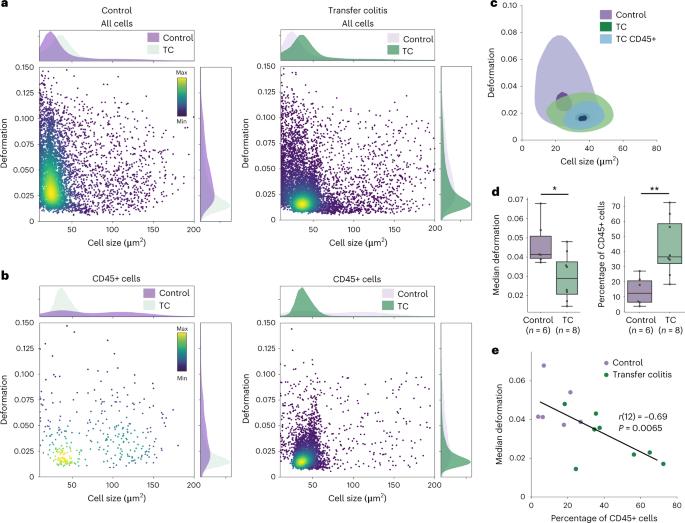
图4| 通过 RT-FDC 进行的细胞物理表型反映了组织炎症
a,与健康小鼠结肠组织(对照)相比,从转移结肠炎组织样本(TC)分离的细胞的细胞大小与形变散点图;具有相应的细胞大小和变形直方图。
b,对相同的两个结肠样本进行CD45阳性细胞门控,显示转移结肠炎样本中白细胞的富集,并伴随着物理表型参数的变化。散点图中的颜色图表示事件密度。
c,a 和 b 中所示样本的核密度估计图,其中等高线标记为 0.5(浅色阴影,外轮廓)和 0.95(深色阴影,内轮廓)水平。
d, 中值变形和CD45阳性细胞百分比的量化(三个独立实验中n = 14只生物学独立的动物)。方框从第 25 个百分位延伸到第 75 个百分位,中间有一条线;晶须跨越 1.5 倍四分位距。使用双边Mann-Whitney U检验进行统计比较。
e,所有细胞变形中值与白细胞(CD45+细胞)比例的双边Pearson相关性;P = 0.0065和r = −0.69。
区分小鼠结肠中的肿瘤组织与健康组织
我们的研究发现,肿瘤组织中的细胞的机械特性与对照样本显著不同,表明我们的方法在检测结直肠癌方面具有潜力。图5a-c中单个小鼠的代表性图表显示,肿瘤中的细胞与其健康对应物相比,细胞大小更大,变形更高。对所有32个样本的分析表明,肿瘤中的细胞具有显著较高的平均细胞大小、变形和面积比,效应大小从中等到强(图5d、e和g)。肿瘤样本还表现出更大的异质性,如图5c中广泛的分布以及细胞大小和面积比的标准偏差显著增加(图5d和g)。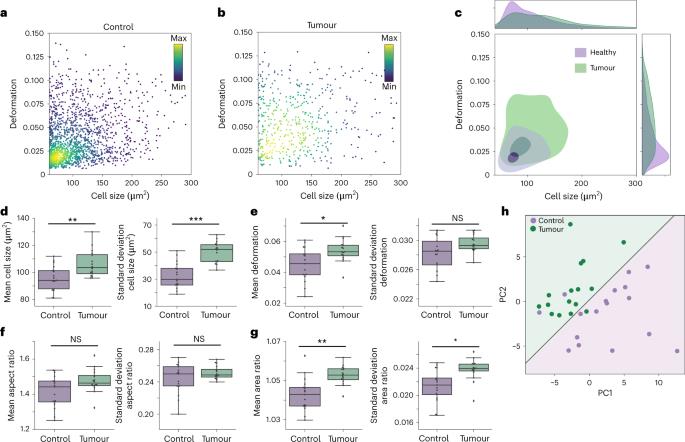
图5 | 小鼠结肠组织中肿瘤和健康组织细胞的物理表型分析
研究团队在验证他们的方法在不同器官组织上的有效性时所采取的步骤和结果。他们将方法应用于来自9名癌症患者的新鲜切除的肺活检样本,并使用主成分分析(PCA)结合逻辑回归来区分健康样本和肿瘤样本。结果显示,他们的方法能够很容易地将7个健康样本与7个肿瘤样本分开,并且进一步正确分类了4个盲样本。在PCA中,PC1和PC2解释了46.9%的方差,其中变形参数对PC1有很大的贡献,表明细胞可变形性测量所带来的独特信息对于区分肿瘤和健康组织是有用的。此外,研究团队还测试了他们的方法对于只存在少量癌细胞的情况的敏感性,如低肿瘤细胞度和广泛的成纤维性肿瘤基质含量的肿瘤,或者经过化学或放射化疗后几乎完全缓解的肿瘤。他们的方法成功地将一个由50%健康和50%肿瘤组织组成的样本分类为肿瘤样本,即使在存在极少量癌细胞的情况下,也能正确地分类样本为肿瘤。
参考文献:Rapid single-cell physical phenotyping of mechanically dissociated tissue biopsies | Nature Biomedical Engineering
我司将致力于将这项革命性的技术带给更多的医疗机构和患者。我们相信,组织研磨分离仪将成为未来医学领域的重要工具,为人类健康事业作出更大的贡献。
让我们携手迈入医学技术的新时代,让组织研磨分离仪成为医学界的强大助力!


